La segunda vida de la talidomida, un fármaco marcado por la tragedia
Los experimentos realizados en algunos modelos animales evidenciaban una escasa actividad sedante y no existían datos sobre su efecto teratogénico, es decir, la posibilidad de producir malformaciones en el feto
Tiempo de lectura estimado: 14 minutos
María Josefa García Barrado, Universidad de Salamanca
En 1954, el mercado farmacéutico estaba en plena expansión y las empresas buscaban tranquilizantes más seguros que los barbitúricos, que en esa época estaban causando un gran número de muertes. Fue entonces cuando la empresa alemana Chemie Grünenthal sintetizó la talidomida, un sedante que no se parecía a ninguno de los existentes. Supuestamente era menos perjudicial.
Los experimentos realizados en algunos modelos animales evidenciaban una escasa actividad sedante y no existían datos sobre su efecto teratogénico, es decir, la posibilidad de producir malformaciones en el feto.
Aun así, tres años más tarde fue autorizada su venta para tratar las náuseas y vómitos durante el embarazo hasta en 50 países. En Francia y Estados Unidos se utilizó con otras indicaciones, tras detectarse algún caso de neuropatía periférica. En España se registró con el nombre comercial de Contergan®.

Graves malformaciones
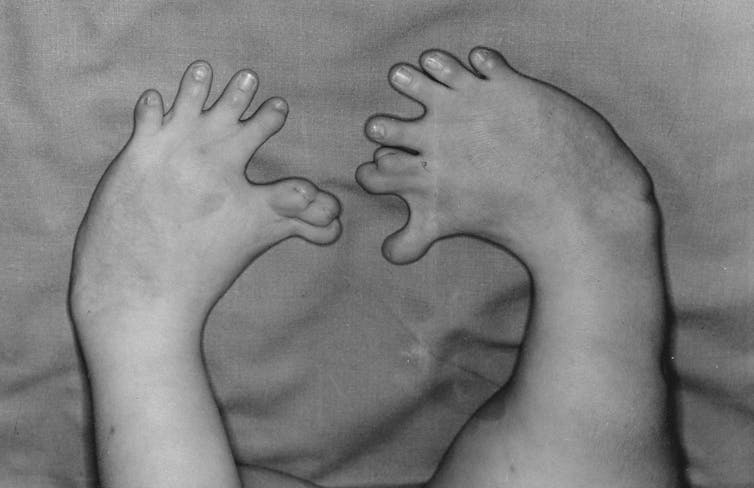
Desgraciadamente, los efectos adversos más impactantes no se hicieron esperar. En todos los países donde se comercializó este fármaco nacieron niños con graves malformaciones. Entre las más frecuentes estaba la focomelia, la ausencia de huesos y músculos en las extremidades superiores o inferiores, pero también vinieron al mundo bebés sin pabellones auditivos, con defectos del paladar y con malformaciones esofágicas y gastrointestinales.
El primero en advertir de que estos efectos teratogénicos podrían estar causados por la talidomida fue Widukind Lenz, clínico y genetista alemán, en 1961. La evidencia hizo que fuera retirado del mercado alemán, aunque en España siguió comercializándose algunos años más.
El descubrimiento de su eficacia en el tratamiento de la lepra hizo que algunas de sus diferentes presentaciones comerciales continuaran vigentes en Latinoamérica y otras latitudes, aún después de que estas fueran prohibidas en 1965.
La repercusión en el mundo científico y la alarma social desatada tuvo notables consecuencias. Hasta ese momento, la evaluación de la eficacia y seguridad de los fármacos no era supervisada por ninguna autoridad sanitaria oficial. Esta desgracia impulsó la creación de organismos independientes para el control de los medicamentos. Por eso, de alguna forma, la talidomida está en el origen de la farmacología clínica y la farmacovigilancia, lo que ha supuesto un importante beneficio para las generaciones posteriores.
Las víctimas, grandes olvidadas
La OMS estima que nacieron más de 10 000 niños con malformaciones graves a consecuencia de la talidomida, si bien algunos elevan esta cifra a casi el doble. Aunque no hay datos oficiales sobre las personas afectadas en Latinoamérica, sus secuelas se han dejado ver sobre todo en Brasil y Perú.
En España se negó durante más de 30 años que el fármaco hubiera sido vendido, con el consiguiente perjuicio para los entre 1 500 y 3 000 recién nacidos con malformaciones. La falta de un registro oficial de afectados ha impedido el acceso de estos a cualquier compensación económica o ayuda sanitaria.
Para ayudar a este colectivo, casi 40 años después se creó la Asociación Española de Víctimas de la Talidomida (AVITE). En 2003, AVITE se preocupó de crear un censo que permitiera un reconocimiento social y una indemnización justa para reparar los daños físicos y morales. Y se trabajó para que esta ayuda fuese comparable con la desarrollada en otros países como Alemania o Reino Unido.
Después de múltiples entrevistas y negociaciones con las autoridades españolas, en 2010 se reconoció, por fin, a los afectados y se reguló el procedimiento de concesión de ayudas. Sin embargo, este colectivo no se rinde y sigue luchando por sus derechos después de que, en 2015, el Tribunal Supremo fallara a favor de la compañía farmacéutica con el argumento de que el caso había prescrito.
Este desamparo hace que las víctimas de la talidomida sigan siendo unos grandes olvidados en nuestra sociedad. Es posible que su reconocimiento, si es que llega algún día, se produzca demasiado tarde.
¿Por qué produce malformaciones en el feto?
A pesar del tiempo transcurrido desde que estalló el escándalo, los mecanismos moleculares que desencadenan las malformaciones, así como parte de sus actividades biológicas, no se conocen con exactitud. Existen hasta 30 hipótesis y modelos para explicarlo. No obstante, dos teorías se impusieron: en primer lugar, las que hacen responsables de la teratogenia a la producción de unas moléculas llamadas especies reactivas de oxígeno (ROS); y en segundo lugar, las que achacan esos efectos a la antiangiogénesis, es decir, su capacidad para inhibir la nueva formación de vasos sanguíneos.
La identificación de la unión de la talidomida a una proteína denominada CEREBLON (CRBN) supuso una ayuda inestimable para identificar el mecanismo que produce las malformaciones. Como consecuencia de dicha unión, se genera la destrucción de otras proteínas, entre las que se encuentra el factor de transcripción denominado SALL4, esencial para el desarrollo de las extremidades.
Sería, pues, en este factor de transcripción SALL4 donde encontraríamos el eslabón perdido en el engranaje teratogénico de la talidomida. De todos modos, estos descubrimientos no se han confirmado en algunos modelos animales, lo cual muestra la diferente susceptibilidad de las especies a la aparición de malformaciones.
El resurgimiento de la talidomida
La talidomia parecía estar condenada al más absoluto de los ostracismos. Sin embargo, en 2001, la Comisión Europea la designó como fármaco huérfano para el tratamiento del mieloma múltiple. Los denominados medicamentos huérfanos generalmente no despiertan ningún interés por parte de la industria farmacéutica. Deben estar destinados a pacientes con enfermedades raras o una dolencia que carece de tratamiento alternativo. Para que un nuevo compuesto se incluya en este grupo, debe brindar beneficios adicionales sobre las terapias disponibles.
La reutilización de la talidomida surgió al pensar que el rápido desarrollo embrionario podría asemejarse al descontrolado crecimiento tumoral. Los datos de estudios in vitro y pruebas clínicas sugieren que los efectos inmunomoduladores, antiinflamatorios y antineoplásicos de la talidomida pueden estar relacionados con la inhibición de la producción del factor de necrosis tumoral (TNF-α) y la modulación de determinadas moléculas de adhesión intercelular, involucradas en la migración de leucocitos y en la actividad antiangiogénica.
Actualmente, este fármaco se prescribe, principalmente, para dos enfermedades: la lepra y el mieloma múltiple. En España, es el tratamiento de elección en pacientes con mieloma múltiple que no han sido tratados anteriormente, siempre combinado con prednisona y melfalán. Se indica a partir de los 65 años o bien en personas más jóvenes que no pueden recibir altas dosis de quimioterapia.
El resurgir de la talidomida, con sus prometedores resultados, no debe borrar su fatídica historia. No se puede repetir la mala praxis que llevó a fatales consecuencias para un colectivo que ha sido arrinconado en el olvido.![]()
María Josefa García Barrado, Profesora titular de Farmacología, Universidad de Salamanca
Este artículo fue publicado originalmente en The Conversation. Lea el original.
¿Cuál es tu reacción?











 Susana V
Susana V 













